(沿岸域の繊毛虫の生活史と生態的機能に係る動画)
有毒プランクトン研究室では、主に貝毒原因生物である有毒プランクトンの研究を行っています。細胞内で有毒物質を合成する有毒プランクトンが発生すると、その有毒プランクトンを餌として捕食した二枚貝のアサリ、ヒオウギ、ホタテガイ、マガキ、ムラサキガイ等の中腸線に毒が蓄積します。これを「貝毒」と呼んでいます。貝毒には、麻痺性貝毒、下痢性貝毒、神経性貝毒、記憶喪失性貝毒と人が患う病状により名前が付けられています。各種貝毒の原因となる有毒プランクトンがそれぞれ存在します。例えば、麻痺性貝毒では、Alexandrium tamarense、Alexandrium catenella、Gymnodinium catenatumなどで、下痢性貝毒では、Dinophysis fortiiやDinophysis acuminataです(下図を参照)。
これまで当研究室では、各種プランクトンの大量発生における水温・塩分・栄養塩、風、潮汐などの気象・海象との関連、増殖速度・生活史(特にシストと呼ばれるたねの役割)など生理・生態特性などの研究を行い、大量発生機構の解明と発生予察、被害防除に向けた取り組みを進めてきました。その中で、現在、特に力を入れている研究は、1)有毒プランクトンの個体群構造の解明、2)有毒プランクトンの迅速・簡便・正確な分子モニタリング技術の開発、毒の迅速・簡便・正確なモニタリング法の開発、3)最近、実験室内で培養できるようになった下痢性貝毒原因種の増殖特性の解明に関する研究、4)次世代シーケンサーを用いたプランクトンメタゲノム・メタトランスクリプトーム解析です。
1)では、近年の有毒プランクトンの発生は、グローバル化の一途を辿っており、世界の沿岸各地で発生するようになり、大きな社会問題として取り上げられています。これら分布拡大の要因として、タンカーのバラスト水や水産種苗の移植に伴う原因プランクトンの輸送が原因であることが指摘されており、有毒プランクトンの個体群を識別する技術、移入・侵入種を判別する技術の開発が望まれてきました。本研究では、有害・有毒微細藻類の出現のグローバル化するメカニズムを解明する手法として、複数種について各海域に分布する個体群を遺伝子レベルで識別する技術開発を行い、個体群の海域間移動の有無、その要因を解明するため研究を行っています。また、他海域への移植のため輸送中の水産種苗や活魚輸送トラックの活魚水槽から、有毒プランクトンの検出と定量を行っております。
2)では、特にAlexandrium属は有毒種・無毒種を含めて、28種もの記載があり形態的がよく似ていて、現場モニタリングにおける正確な種同定・定量を困難にしています。そこで、同定が困難な種について、誰でも迅速・簡便・正確に行える分子生物学的技術の開発を目指しています。これまでリアルタイムPCR(Polymerase Chain Reaction)法、FISH(Fluorescent In Situ Hybridization)法などの他に、LAMP(Loop-Mediated Isothermal Amplification)法の開発を行ってきました。特にLAMP法は、当研究室の自信作で、分子生物学的実験を行うための高額な分析機器などを全く必要とせず、誰でも迅速・簡単・正確に種の有毒種の判定が出来るようになりました。また、現在、複数の有害・有毒種を特異的に検出するプローブを1つの平面基盤上に埋め込んだDNAチップの開発も手がけています。一方、毒の検出も従来のマウスアッセイ法やHPLC(高速液体クロマトグラフィー)に代わる迅速・簡単・正確な方法として、ELISA(enzyme Linked Immunosorbent Assay)法を用いた検出・定量法の研究開発を行っています。
3)では、プランクトンの研究が始まって以来、下痢性貝毒原因種であるDinophysis属の培養に成功した研究者がおらず、下痢性貝毒の発生メカニズムの多くの部分は未解明のままでした。そんな中、韓国のPark et al. (2006)が世界で初めてD. acuminataの培養に成功しました。我々も続いて成功し、現在、中央水産研究所と共同で、我が国における下痢性貝毒の主要原因種であるD. acuminata、D. fortiiを含む5種の培養を行い、多くの重要な実験データを蓄積しているところです。今後、これら研究の進展により、下痢性貝毒の発生に関わる要因を解明し、予察・防除といった研究に役立てていく予定です。
4)では、2008年から本年にかけて相次いで商品化された次世代シーケンサーの登場により、生命科学とバイオ産業に大きな変革が起きています。次世代型と呼ばれるシーケンサーは、従来型シーケンサーの数十〜数百倍の性能を発揮します。このようなシーケンス革命の到来により、従来の細胞の形態情報を重視していた赤潮・貝毒プランクトンのモニタリングだけではなく、大量に得られるゲノム情報をフル活用した新技術を取り入れていく必要があると考えています。
出現プランクトンの種類数とモニタリングの実情
最近の研究で、藻類はおよそ11の植物門に分類されています。細胞の形態情報(かたち)、葉緑体の組成と構造、生活史、遺伝子配列などが、分類の基準となっています。比較的大型(20〜500 μm)の植物プランクトンでは、ゲノム情報を登録したデータベースは充実してきましたが、採集した地点などの詳しい情報が登録されておらず、10 μmより小型の超微細種の情報になると、何種類いるのか未だに不明です。動物プランクトン・無脊椎動物群は、植物プランクトン同様、極めて多様な動物群を含み、分布域、生活史などの生態も多様性に富んでおり、数万種数の存在が推定されています。動物プランクトンに特化したデータベースもあり、形態情報とゲノムの情報の総合化を目指した取り組みが行われています。
都道府県の海洋・水質調査している研究機関では、1970年代前半から、浅海定線調査事業などを利用して日本沿岸の環境モニタリングを実施しており、その中で、動植物プランクトンのモニタリングを行ってきました。動植物プランクトンのデータは蓄積されてきたのですが、優占種の情報がほとんどであり、希少種や微細な植物プランクトンの情報はほとんどない状況にあります。
次世代シーケンサーによるプランクトン出現種の分子モニタリング
全ての海洋プランクトンの染色体上にコードされている共通の遺伝子領域について遺伝子増幅を行い、次世代シーケンサーを用いた配列解析を行うことで、全出現種の記録と出現種の多様性の比較をしてみました(図参照)。2009年に広島湾から表層海水を5回採集し、海水中各250 mLに出現したプランクトン種の約3万個の配列について調べてみました。その結果、約1,500個の異なる配列が検出され、植物プランクトンと海藻については、606個の異なる配列のうち、492個について9門28綱に分類される生物群で属名・種名を判別することができました(表参照)。ツリガネムシ、ラッパムシなどの繊毛虫では、1門5綱39個の配列で属名・種名の判別が可能であり、アメーバ等の原生生物門では150個の異なる配列が検出されたうち、99個で属名・種名の判定が可能でした。動物界(海産無脊椎動物+魚類)では、167個の異なる配列が検出され、驚いたことに、海綿、クラゲ、ホヤ、貝類、ゴカイなど多数の動物門等に属する種が検出され、全ての配列で属名・種名の判定が可能でした。一方で,不明な生物群としてどの生物門にも属さない522個の配列が検出され,全体(1,500個)の34%,総配列数(3万個)のうちの42%に及びました。
このように、属名・種名がついていない不明種の配列はまだまだ多数あり、今回行った解析を効率よく実施する上で障壁となっていますが、それでも1リットル程度の海水から約1,500個(種)もの遺伝子を検出する技術開発に成功しました。また、多数の有害・有毒プランクトンだけではなく、汚染指標となる生物群も多数検出されました。本手法を用いると海域の富栄養化の程度や底質の汚染度の比較もおそらく可能であり、外来種の鋭敏な検出にも有効な手法であると思います。
以上、本解析は、海洋生物の分子モニタリング手法として最もパワフルな手法の一つであり、出現種の検出だけではなく定量性を付加することで、新たな海洋プランクトンのモニタリング手法としての活用が期待されます。近い将来、多くの試験研究機関等での動植物プランクトンの出現モニタリングにも活用できるよう、技術開発を継続したいと考えています。
| 研究室のメンバー紹介 | |
| 研究業績--長井 敏 |
|
| |
その他研究情報--神山 孝史 (沿岸域の繊毛虫の生活史と生態的機能に係る動画) |

図.A:麻痺性貝毒原因渦鞭毛藻Gymnodinium catenatumの遊泳細胞 B:培養条件下で形成されたシスト(種)

図.A:麻痺性貝毒原因渦鞭毛藻Alexandrium tamiyavanichiiの遊泳細胞 B:遊泳細胞の鎧板の観察 C:培養条件下で形成されたシスト(種)
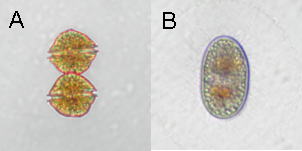
図.A:麻痺性貝毒原因渦鞭毛藻Alexandrium tamarenseの遊泳細胞 B:培養条件下で形成されたシスト(種)

図.A:下痢性貝毒原因渦鞭毛藻Dinophysis fortiiの遊泳細胞 B:Dinophysis caudataの遊泳細胞

図.有毒渦鞭毛藻を捕食する渦鞭毛藻 A:Polykrikos kofoidii B:Polykrikos schwartzii

図.プランクトンメタゲノム解析手法の概念図
表.広島湾におけるプランクトンメタゲノム解析結果の概略(予備的検討の結果)

瀬戸内海区水産研究所のホームページに戻る